Jau sen ir zināms, ka visām molekulām ir divi vienādi un pretēji lādiņi, kurus atdala noteikts attālums. Šādu polāro molekulu gadījumā negatīvā lādiņa centrs nesakrīt ar pozitīvā lādiņa centru. Polaritātes pakāpi šādās kovalentās molekulās var aprakstīt ar terminu Dipola moments, kas būtībā ir polaritātes mērs polārajā kovalentajā saitē.
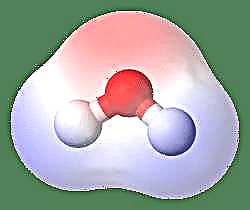
Vienkāršākais dipola piemērs ir ūdens molekula. Ūdens molekula ir polāra, jo tās elektroni nevienmērīgi dalās “saliektā” struktūrā. Ūdens molekula veido leņķi ar ūdeņraža atomiem galos un ar skābekli virsotnē. Tā kā skābeklim ir augstāka elektronegativitāte nekā ūdeņradim, molekulas pusei ar skābekļa atomu ir daļējs negatīvs lādiņš, kamēr ūdeņradim centrā ir daļēja pozitīva lādiņa. Sakarā ar to dipola momenta virziens norāda uz skābekli.
Fizikas valodā elektriskais dipola moments ir pozitīvu un negatīvu elektrisko lādiņu atdalīšanas lādiņu sistēmā, tas ir, lādēšanas sistēmas vispārējās polaritātes mērījums, ti, molekulu elektriskā lādiņa atdalīšana, kas ved uz dipolu. Matemātiski un vienkāršā divu punktu lādiņu gadījumā, viens ar lādiņu + q un otrs ar lādiņu? Q, elektrisko dipola momentu p var izteikt šādi: p = qd, kur d ir pārvietojuma vektors, kas norāda no negatīvās lādiņa uz pozitīvais lādiņš. Tādējādi elektriskā dipola momenta vektors p norāda no negatīvā lādiņa uz pozitīvo lādiņu.
Vēl viens veids, kā to aplūkot, ir Dipola momenta attēlojums ar grieķu burtu m, m = ed, kur e ir elektriskais lādiņš un d ir atdalīšanas attālums. To izsaka Debye vienībās un raksta kā D (kur 1 Debye = 1 x 10-18e.s.u cm). Dipola moments ir vektora lielums, tāpēc to attēlo ar mazu bultiņu ar asti pozitīvajā centrā un galvu, kas vērsta uz negatīvo centru. Ūdens molekulas gadījumā dipola moments ir 1,85 D, turpretī sālsskābes molekula ir 1,03 D un to var attēlot šādi:
Mēs esam rakstījuši daudz rakstu par dipola brīdi Space Magazine. Šis ir raksts par to, no kā tiek izgatavots ūdens, un šeit ir raksts par molekulām.
Ja vēlaties iegūt vairāk informācijas par dipola brīdi, skatiet šos Hyperphysics and Science Daily rakstus.
Mēs esam ierakstījuši arī veselu epizodi no astronomijas, kurā tiek runāts par visām molekulām kosmosā. Klausieties šeit, 116. epizode: molekulas kosmosā.
Avoti:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule