20. gadsimta sākums bija ļoti labvēlīgs laiks zinātnēm. Papildus Ernestam Rutherfordam un Nīlam Boram, kurš dzemdēja daļiņu fizikas standarta modeli, tas bija arī atklājumu periods kvantu mehānikas jomā. Pateicoties notiekošajiem pētījumiem par elektronu uzvedību, zinātnieki sāka piedāvāt teorijas, saskaņā ar kurām šīs elementārdaļiņas izturējās tā, lai neklasētu klasisko, Ņūtona fiziku.
Viens no šādiem piemēriem ir Ervina Šrodingera ierosinātais elektronu mākoņu modelis. Pateicoties šim modelim, elektroni vairs netika attēloti kā daļiņas, kas pārvietojas ap centrālo kodolu fiksētā orbītā. Tā vietā Šrodingers ierosināja modeli, saskaņā ar kuru zinātnieki varēja izdarīt tikai izglītotus minējumus par elektronu pozīcijām. Tādējādi to atrašanās vietas var raksturot tikai kā “mākoņa” daļu ap kodolu, kur, iespējams, atrodami elektroni.
Atomfizika līdz 20. gadsimtam:
Agrākie zināmie atomu teorijas piemēri nāk no senās Grieķijas un Indijas, kur tādi filozofi kā Democritus postulēja, ka visa matērija sastāv no niecīgām, nedalāmām un neiznīcināmām vienībām. Termins “atoms” tika radīts senajā Grieķijā un radīja domas skolu, kas pazīstama kā “atomisms”. Tomēr šī teorija drīzāk bija filozofiska, nevis zinātniska.
Tikai 19. gadsimtā atomu teorija kļuva par zinātnisku jautājumu, un tika veikti pirmie uz pierādījumiem balstīti eksperimenti. Piemēram, 1800. gadu sākumā angļu zinātnieks Džons Daltons izmantoja atoma jēdzienu, lai izskaidrotu, kāpēc ķīmiskie elementi reaģēja noteiktos novērojamos un paredzamos veidos. Veicot virkni eksperimentu, kas saistīti ar gāzēm, Daltons turpināja attīstīt tā dēvēto Daltona atomu teoriju.
Šī teorija izvērsa masu un noteiktu proporciju sarunu likumus un nonāca pie piecām telpām: elementi, tīrākajā stāvoklī, sastāv no daļiņām, kuras sauc par atomiem; noteikta elementa atomi ir vienādi, līdz pat pēdējam atomam; dažādu elementu atomus var atšķirt pēc to atomu svara; elementu atomi apvienojas, veidojot ķīmiskus savienojumus; atomus nevar ne radīt, ne iznīcināt ķīmiskajā reakcijā, tikai grupas vienmēr mainās.
Elektrona atklāšana:
Līdz 19. gadsimta beigām zinātnieki arī sāka teorēt, ka atoms sastāv no vairāk nekā vienas pamatvienības. Tomēr vairums zinātnieku uzdrošinājās, ka šī vienība būs mazākā zināmā atoma - ūdeņraža - izmērs. Līdz 19. gadsimta beigām viņa krasi mainīsies, pateicoties pētījumiem, kurus veikuši tādi zinātnieki kā sers Džozefs Džons Thomsons.
Veicot virkni eksperimentu, izmantojot katodstaru lampas (pazīstamas kā Crookes 'Tube), Thomson novēroja, ka katoda starus var novirzīt ar elektrisko un magnētisko lauku. Viņš secināja, ka tā vietā, lai tos veidotu no gaismas, tie bija veidoti no negatīvi lādētām daļiņām, kas bija 1 reizes reižu mazākas un 1800 reizes vieglākas nekā ūdeņradis.

Tas faktiski atspēkoja uzskatu, ka ūdeņraža atoms ir mazākā matērijas vienība, un Tompsons devās tālāk, liekot domāt, ka atomi ir dalāmi. Lai izskaidrotu kopējo atoma lādiņu, kas sastāvēja no gan pozitīvajiem, gan negatīvajiem lādiņiem, Tompsons ierosināja modeli, kurā negatīvi lādētie “asinsķermenīši” tika sadalīti vienotā pozitīvā lādiņa jūrā - pazīstams kā Plum Pudding Model.
Šie asinsķermenīši vēlāk tiks nosaukti par “elektroniem”, pamatojoties uz teorētiskajām daļiņām, ko 1874. gadā paredzēja anglo-īru fiziķis Džordžs Džonstons Stonejs. Un no tā radās Plūmju pudinga modelis, kas tika nosaukts tāpēc, ka tas ļoti līdzinājās angļu tuksnesim, kas sastāv no plūmju kūka un rozīnes. Koncepcija tika iepazīstināta ar pasauli Apvienotās Karalistes 1904. gada marta izdevumā Filozofiskais žurnāls, uz plašu atzinību.
Standarta modeļa izstrāde:
Turpmākie eksperimenti atklāja vairākas zinātniskas problēmas ar Plum Pudding modeli. Iesācējiem radās problēma pierādīt, ka atomam ir vienāds pozitīvs fona lādiņš, ko sauca par “Thomson problēmu”. Pēc pieciem gadiem modeli atspēkos Hanss Geigers un Ernests Marsdens, kuri veica virkni eksperimentu, izmantojot alfa daļiņas un zelta foliju - aka. “zelta folijas eksperiments”.
Šajā eksperimentā Geigers un Marsdens izmērīja alfa daļiņu izkliedes modeli ar dienasgaismas ekrānu. Ja Thomsona modelis būtu pareizs, alfa daļiņas netraucēti šķērsotu folijas atomu struktūru. Tomēr tā vietā viņi atzīmēja, ka, lai gan lielākā daļa tika izšauti taisni cauri, daži no tiem tika izkliedēti dažādos virzienos, bet daži devās atpakaļ avota virzienā.

Geigers un Marsdens secināja, ka daļiņas ir saskārušās ar elektrostatisko spēku, kas ir daudz lielāks, nekā to atļauj Tomsona modelis. Tā kā alfa daļiņas ir tikai hēlija kodoli (kas ir pozitīvi lādēti), tas nozīmēja, ka pozitīvais lādiņš atomā nebija plaši izkliedēts, bet koncentrēts nelielā tilpumā. Turklāt fakts, ka tās daļiņas, kuras nebija novirzītas, šķērsoja netraucēti, nozīmēja, ka šīs pozitīvās telpas atdalīja milzīgas tukšas telpas līči.
Līdz 1911. gadam fiziķis Ernests Rutherfords interpretēja Geigera-Marsdena eksperimentus un noraidīja Tomsa atoma modeli. Tā vietā viņš ierosināja modeli, kurā atoms sastāvēja galvenokārt no tukšas vietas, ar visu pozitīvo lādiņu koncentrējoties tā centrā ļoti niecīgā tilpumā, kuru ieskauj elektronu mākonis. Tas kļuva pazīstams kā Rutherforda atoma modelis.
Turpmākie Antonija Van den Brūka un Nīla Bora eksperimenti modeli vēl pilnveidoja. Kamēr Van den Brūks ierosināja, ka elementa atomu skaits ir ļoti līdzīgs tā kodola lādiņam, pēdējais ierosināja Saules sistēmai līdzīgu atoma modeli, kur kodolā ir pozitīvā lādiņa atomu skaits un to ieskauj vienāda elektronu skaits orbītas apvalkos (pazīstams arī kā Bohra modelis).
Elektronu mākoņu modelis:
1920. gados austriešu fiziķis Ervins Šrodingers aizrauj teorijas Makss Planks, Alberts Einšteins, Nīls Bohrs, Arnolds Sommerfelds un citi fiziķi. Šajā laikā viņš iesaistījās arī atomu teorijas un spektru jomās, veicot pētījumus Cīrihes universitātē un pēc tam Frīdriha Vilhelma universitātē Berlīnē (kur 1927. gadā viņš pēctecis Planks).

1926. gadā Šrēdingers daudzās rakstu sērijās pievērsās viļņu funkciju un elektronu problēmai. Papildus tam, lai aprakstītu to, kas varētu tikt dēvēts par Šrodingera vienādojumu - daļēju diferenciālvienādojumu, kas apraksta, kā kvantu sistēmas kvantu stāvoklis mainās laika gaitā -, viņš arī izmantoja matemātiskos vienādojumus, lai aprakstītu iespējamību atrast elektronu noteiktā stāvoklī. .
Tas kļuva par pamatu tam, kas tiks dēvēts par elektronu mākoņu (vai kvantu mehānisko) modeli, kā arī Šrodingera vienādojumu. Balstoties uz kvantu teoriju, kurā teikts, ka visai matērijai ir īpašības, kas saistītas ar viļņu funkciju, elektronu mākoņu modelis atšķiras no Boha modeļa ar to, ka tas nenosaka precīzu elektronu ceļu.
Tā vietā tas, pamatojoties uz varbūtību funkciju, prognozē elektronu atrašanās vietas iespējamo atrašanās vietu. Varbūtības funkcija pamatā apraksta mākoņiem līdzīgu reģionu, kurā, iespējams, tiks atrasts elektrons, tātad arī nosaukums. Tur, kur mākonis ir visblīvākais, vislielākā ir varbūtība atrast elektronu; un kur elektrons ir mazāk ticams, mākonis ir mazāk blīvs.
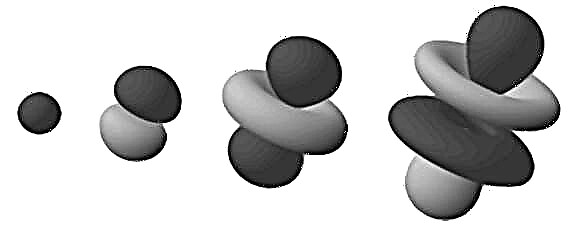
Šie blīvie reģioni ir zināmi kā “elektronu orbitāles”, jo tie, visticamāk, ir vieta, kur tiks atrasts riņķojošs elektrons. Paplašinot šo “mākoņa” modeli līdz trīsdimensiju telpai, mēs redzam stieni vai zieda formas atomu (kā attēlā augšā). Šeit visdrīzāk elektronus atradīsim sazarojošie reģioni.
Pateicoties Šrodingera darbam, zinātnieki sāka saprast, ka kvantu mehānikas jomā nav iespējams uzzināt precīzu elektrona atrašanās vietu un impulsu vienlaikus. Neatkarīgi no tā, ko novērotājs sākotnēji zina par daļiņu, viņi varbūtību ziņā var paredzēt tikai nākamo tās atrašanās vietu vai impulsu.
Nevienā brīdī viņi nevarēs noskaidrot nevienu no tām. Faktiski, jo vairāk viņi zinās par daļiņas impulsu, jo mazāk viņi zinās par tā atrašanās vietu un otrādi. Tas ir tas, ko šodien sauc par “nenoteiktības principu”.
Ņemiet vērā, ka iepriekšējā rindkopā minētās orbitāles veido ūdeņraža atoms (t.i., tikai ar vienu elektronu). Darbojoties ar atomiem, kuriem ir vairāk elektronu, elektronu orbitāli reģioni vienmērīgi izkliedējas sfēriskā izplūdušajā bumbiņā. Šeit vispiemērotākais ir termins “elektronu mākonis”.
Šis ieguldījums tika vispāratzīts kā viens no 20. gadsimta nozīmīgajiem ieguldījumiem un tāds, kas izraisīja revolūciju fizikas, kvantu mehānikas un patiešām visu zinātņu jomās. Turpmāk zinātnieki vairs nedarbojās Visumā, kam raksturīgi laika un telpas absolūti, bet gan kvantu nenoteiktībā un laika-telpas relativitātē!
Mēs šeit Space Magazine esam uzrakstījuši daudz interesantu rakstu par atomiem un atomu modeļiem. Lūk, kas ir Džona Daltona atomu modelis ?, Kas ir plūmju pūšanas modelis ?, Kas ir Boha atomu modelis ?, Kas bija Democritus? Un kādas ir atoma daļas?
Lai iegūtu papildinformāciju, noteikti pārbaudiet Kas ir kvantu mehānika? no dzīvās zinātnes.
Astronomijas skatei ir arī epizode par šo tēmu, piemēram, epizode 130: radioastronomija, epizode 138: kvantu mehānika un epizode 252: Heizenberga nenoteiktības princips